Inleiding
De behandeling van kanker bij kinderen is het voorbeeld van succes van de moderne geneeskunde. Zo kunnen ziekten worden genezen die vroeger als ongeneeslijk werden beschouwd. De huidige gemiddelde 5 jaarsoverleving van alle soorten kanker bedraagt meer dan 80%. De behandeling van sequelae als gevolg van de behandeling van die groeiende populatie van kinderen die kanker hebben overleefd, is een nieuwe uitdaging geworden voor kinderoncologen (1, 2).
In een rapport van de CCSS-groep (Childhood Cancer Survivor Study) staat dat de cumulatieve incidentie van gezondheidsproblemen 30 jaar na de behandeling 73% bedraagt, waarvan 42% ernstige problemen of overlijden (3). Eén van de ernstige chronische problemen was cardiotoxiciteit, hoofdzakelijk als gevolg van gebruik van antracyclines en/of radiotherapie op het mediastinum.
Cardiotoxiciteit van de kankertherapieën die in de pediatrie worden gebruikt: samenvatting van onze huidige kennis
Incidentie van cardiale bijwerkingen
De incidentie van cardiotoxiciteit verschilt sterk van de ene tot de andere studie. De totale frequentie van cardiotoxiciteit bedraagt 0 tot 16% als alleen patiënten met hartinsufficiëntie in beschouwing worden genomen, en 57% als ook rekening wordt gehouden met patiënten met een subklinische disfunctie van het hart (4). De cumulatieve incidentie van cardiovasculaire morbiditeit na bestraling van het mediastinum wordt geraamd op 0,3 tot 22,8% (5). Het spectrum van hartaandoeningen als gevolg van kankertherapie gaat van ernstige hartinsufficiëntie tot een subklinische aantasting en naarmate er meer gesofisticeerde beeldvormingstechnieken worden toegepast, stijgt de incidentie van complicaties. Dat kan gedeeltelijk de verschillen tussen de studies verklaren. Andere verklaringen zijn verschillen in de dosering van antracyclines, de stralingsdoses en de duur van de follow-up (6). In 2010 werd aangetoond dat de gestandaardiseerde sterfte aan hart- en vaataandoeningen bij patiënten die kanker tijdens de kinderjaren hadden overleefd (n = 4.122), 5-maal hoger was dan in de algemene bevolking (7).
Cardiotoxische behandelingen: risicofactoren en werkingsmechanismen
Cardiotoxiciteit op lange termijn wordt vooral veroorzaakt door antracyclines en radiotherapie. Er zijn nog andere geneesmiddelen die acute of subacute cardiotoxiciteit kunnen veroorzaken, maar we zullen het hier alleen hebben over antracyclines en radiotherapie.
Antracyclines
De cardiotoxiciteit die wordt veroorzaakt door antracyclines, wordt doorgaans in drie groepen ingedeeld: acute, chronisch progressieve met vroeg begin en chronisch progressieve met laat begin.
-
De acute toxiciteit van antracyclines treedt typisch op tijdens de eerste week van de behandeling, maar komt zelden voor (< 1%) en is doorgaans van voorbijgaande aard en reversibel na stopzetting van de behandeling. Het risico op late chronische disfunctie blijkt hoger te zijn bij patiënten bij wie een dergelijke acute disfunctie werd gediagnosticeerd (8).
-
Chronische progressieve cardiomyopathie met vroeg begin treedt op minder dan één jaar na de behandeling en voorspelt vaak een late cardiotoxiciteit (9).
-
Chronische progressieve cardiomyopathie met laat begin komt tot uiting jaren of tientallen jaren na het einde van de behandeling (2).
Er zijn meerdere risicofactoren voor vroege of late chronische progressieve cardiotoxiciteit bekend. De cumulatieve dosis is duidelijk de belangrijkste voorspellende factor (5). Hoewel in de literatuur verschillende cut-offwaarden worden vermeld waarboven het risico op cardiotoxiciteit stijgt (7, 8), zou er volgens recente studies geen veilige dosis bestaan die geen cardiotoxiciteit veroorzaakt (en dat geldt dan vooral voor late chronische disfunctie van het hart) (10, 12). De prevalentie van hartproblemen stijgt naarmate de patiënten langer worden gevolgd na toediening van het geneesmiddel (5, 8). Ook een jonge leeftijd (< 4-5 jaar) (5, 9) en combinatie met radiotherapie van het mediastinum werken cardiale bijwerkingen in de hand (5). Meisjes lopen veel meer risico op cardiotoxiciteit (5-14), waarschijnlijk omdat antracyclines niet goed door het vetweefsel worden geabsorbeerd. Aangezien vrouwen een hoger percentage vetweefsel hebben, resulteert dat in een hogere concentratie van het geneesmiddel in de hartspier. Een genetische aanleg (met daardoor een geringere klaring van die geneesmiddelen), trisomie 21, het zwarte ras, hyperthermie, leveraandoeningen en een vooraf bestaande hartziekte werden ook in verband gebracht met een hoger risico op cardiotoxiciteit (4).
Bij patiënten met risicofactoren die een soortgelijke behandeling hebben gekregen, worden ook verschillen in de vatbaarheid voor toxiciteit van antracyclines gezien. Dat wijst erop dat een genetische component een rol speelt bij de respons op antracyclines. Recentelijk werden verschillende genen ontdekt die geassocieerd zijn met cardiotoxiciteit van antracyclines. In de toekomst zou een combinatie van het genetische risicoprofiel en klinische risicofactoren kunnen helpen bij het opsporen van patiënten die een hoog risico op cardiotoxiciteit lopen (15, 16). Die patiënten zouden dan beter kunnen worden opgespoord en zouden dan een follow-up op maat kunnen krijgen.
De toxiciteit van antracyclines is hoofdzakelijk toe te schrijven aan de productie van vrije radicalen, die de cardiomyocyten beschadigen. Hartspiercellen zijn gevoeliger voor vrije radicalen dan andere cellen.
Bij microscopisch onderzoek wordt de schade die wordt veroorzaakt door antracyclines, gekenmerkt door een verlies van myofibrillen, fibrose en degeneratie van bloedvaten. De ernst van die afwijkingen correleert met de totale dosis van antracyclines. Aangezien myocyten zich na de leeftijd van zes maanden nog zelden delen, is de groei van het myocard alleen toe te schrijven aan het groter worden van de myocyten. De belangrijkste manier om het verlies van myocyten als gevolg van een behandeling met antracyclines te compenseren is dan ook een sterkere hypertrofie van de myocyten om de architectuur en de contractiliteit van het hart te handhaven. De hartinsufficiëntie die laat na een behandeling met antracyclines optreedt, is toe te schrijven aan het onvermogen van de resterende myocyten om de toenemende belasting van het hart als gevolg van de normale groei van het lichaam, een zwangerschap of andere metabole belastingen te compenseren.
Radiotherapie
Radiotherapie van het mediastinum of de thorax kan leiden tot een disfunctie van het hart. In de studie van Tukenova werd vastgesteld dat de totale cardiovasculaire sterfte significant hoger was bij mensen die een gemiddelde stralingsdosis van meer dan 5Gy hadden gekregen (7). Mulrooney heeft aangetoond dat blootstelling van het hart aan een stralingsdosis van 15Gy of meer het relatieve risico op congestieve hartinsufficiëntie, myocardinfarct, pericardlijden en klepaantasting verdubbelt tot verzesvoudigt in vergelijking met patiënten die kanker hebben overleefd en daar niet voor werden bestraald (6).
De schade kan geleidelijk opkomen en de patiënten kunnen jarenlang asymptomatisch blijven. Fibrose is het histologische merkteken van hartlijden als gevolg van radiotherapie (16).
Langetermijnstudies
De laatste 10 jaar is duidelijk geworden dat het belangrijk is patiënten die tijdens de kinderjaren kanker hebben overleefd, gedurende lange tijd te volgen (3, 6-13, 17). De studiecohorten waren echter heterogeen in termen van inclusiecriteria, duur van de follow-up, techniek van cardiovasculaire bewaking, de gemiddelde leeftijd op het ogenblik dat de diagnose werd gesteld, de dosis en het type antracycline en de ontvangen stralingsdosis.
De belangrijkste follow-upstudies worden weergegeven volgens de duur van de follow-up (Tabel 1). Die lijst is niet volledig, maar we hebben die studies geselecteerd gezien hun zeer lange follow-up, het grote aantal patiënten of omdat ze significante informatie bieden.
De studies met het grootste aantal patiënten zijn de studies van de CCSS-groep (Tabel 1-b), de Franse en Engelse cohorte (Tabel 1-c) en de Noorse studie (Tabel 1-d).
In 2001 werd in de eerste, retrospectieve cohortestudies al gewezen op het belang van de morbiditeit op lange termijn en de cardiovasculaire sterfte bij patiënten die als kind kanker hadden overleefd (13). In die studies werd aangetoond dat de totale sterfte mettertijd steeg en duidelijk hoger was dan de normale sterfte in de algemene bevolking. De sterfte was significant lager bij de patiënten die tijdens de laatste periode van de studie waren behandeld (jaren 1980-1989), waarschijnlijk omdat men toen de toxiciteit van chemotherapie beter kende en beter oplette bij het gebruik van dergelijke geneesmiddelen (13).
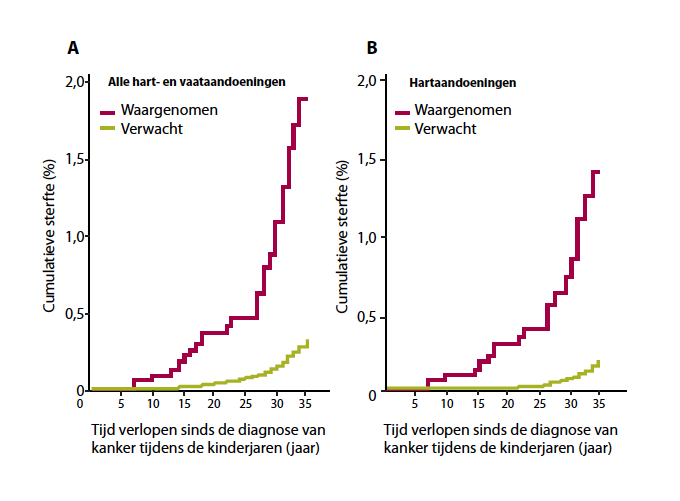
Mulrooney et al. (Tabel 1-b) hebben aangetoond dat de cumulatieve incidentie van cardiale morbiditeit bleef stijgen tot 30 jaar na de diagnose (6). In 2010 hebben Kenney et al. (Tabel 1-a) een kleine reeks gepubliceerd van 107 patiënten die vrij lang werden gevolgd (18). Daarin werd bevestigd dat de overlevenden meer dan 50 jaar na het einde van de chemotherapie en/of de radiotherapie nog altijd een risico op hartlijden liepen met daardoor een achteruitgang van de levenskwaliteit en zelfs een daling van de levensverwachting. In de studie van Guldner (Tabel 1-e) werd aangetoond dat ook radiotherapie het risico op hartlijden op lange termijn verhoogt (17). Tukenova et al. (Tabel 1-c) bevestigden dat de cardiovasculaire sterfte verhoogd was bij patiënten die meer dan 5Gy op de hartspier hadden gekregen, en patiënten die een cumulatieve dosis antracyclines ≥ 360mg/m2 hadden gekregen. In die groep namen de cumulatieve cardiale mortaliteit en de cumulatieve incidentie van hartinsufficiëntie (Figuur 1) na verloop van tijd toe, ook na 20 jaar follow-up (7).
| Figuur 1: Sterfte als gevolg van cardiovasculaire (A) en cardiale aandoeningen (B) in de Frans-Engelse cohorte van patiënten die als kind werden behandeld wegens kanker, in vergelijking met de algemene Franse en Engelse bevolking (7). |
|---|
 |
Er is nog controverse over de laagste cumulatieve dosis van antracyclines die cardiotoxisch kan zijn. Volgens sommige auteurs (Tabel 1-f) vertonen patiënten die een cumulatieve dosis < 250mg/m² hebben gekregen, zelden een verslechtering van hun hartfunctie (8). In recentere studies werd evenwel aangetoond (Tabel 1-g, 1-h en 1-i) dat ook lage doses van antracyclines (45 tot 250mg/m²) een disfunctie van het hart kunnen veroorzaken met een daling van de linkerventrikelmassa (9-11). Dat wijst erop dat doxorubicine altijd cardiotoxisch is.
Conclusies
De overleving van de meeste kankers bij kinderen is de laatste decennia opmerkelijk verbeterd (1).
Door dat succes worden we nu geconfronteerd met de morbiditeit en de mortaliteit als gevolg van kankerbehandelingen. Patiënten die als kind kanker hebben overleefd, kunnen immers allerhande bijwerkingen ontwikkelen (1-3). Cardiotoxiciteit is één van de ernstigste chronische complicaties met een hoge mortaliteit, die ook meerdere tientallen jaren na de behandeling aanhoudt. Daarom is het zo belangrijk om grootschalige studies op touw te zetten naar de bijwerkingen van chemo- en radiotherapie. Er werden nog maar weinig grote, internationale studies uitgevoerd en het gaat dan nog merendeels om monocentrische studies bij een beperkt aantal patiënten met een welbepaalde aandoening, met verschillende parameters voor cardiale monitoring en een follow-up die sterk verschilt van de ene studie tot de andere. De resultaten van die studies zijn dan ook moeilijk met elkaar te vergelijken.
De laatste 5 jaar is de overleving niet meer duidelijk veranderd. Dat wijst erop dat nu strategieën voor bewaking en follow-up van onze patiënten en vernieuwende behandelingen nodig zijn om de resultaten te verbeteren. Er moeten klinische studies worden uitgevoerd met nieuwe behandelingen, die niet alleen tot doel hebben de overleving te verbeteren, maar die ook minder late bijwerkingen veroorzaken. De toekomstige behandelingen zouden ervoor moeten zorgen dat kinderen bij wie een diagnose van kanker wordt gesteld, geen sequelae op lange termijn krijgen (1).
In een volgend artikel bespreken we de screening, de preventie en de behandeling van cardiotoxiciteit als gevolg van kankertherapie bij kinderen.
Dankwoord
Deze studie werd gesteund door het Fonds national de la Recherche scientifique (Grant Télévie - FNRS n°7.4637.09), het Fonds national pour la Recherche en Cardiologie pédiatrique, de Stichting Salus Sanguinis en het Centre du Cancer van de Cliniques universitaires St-Luc.
Referenties
1. Smith MA, Seibel NL, Altekruse SF, et al. Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 2010;28:2625-34.
2. Hudson MM. Survivors of childhood cancer: coming of age. Hematol Oncol Clin North Am 2008;22:211-31.
3. Oeffinger KC, Mertens AC, Sklar CA, et al. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med 2006;355:1572-82.
4. Lipshultz SE, Alvarez JA, Scully RE. Anthracycline associated cardiotoxicity in survivors of childhood cancer. Heart 2008;94:525-33.
5. van der Pal HJ, van Dalen EC, Kremer LC, et al. Risk of morbidity and mortality from cardiovascular disease following radiotherapy for childhood cancer: a systematic review. Cancer Treat Rev 2005;31:173-85.
6. Mulrooney DA, Yeazel MW, Kawashima T, et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ 2009;339:b4606.
7. Tukenova M, Guibout C, Oberlin O, et al. Role of cancer treatment in long-term overall and cardiovascular mortality after childhood cancer. J Clin Oncol 2010;28:1308-15.
8. Sorensen K, Levitt GA, Bull C, et al. Late anthracycline cardiotoxicity after childhood cancer: a prospective longitudinal study. Cancer 2003;97:1991-8.
9. Hudson MM, Rai SN, Nunez C, et al. Noninvasive evaluation of late anthracycline cardiac toxicity in childhood cancer survivors. J Clin Oncol 2007;25:3635-43.
10. Rathe M, Carlsen NL, Oxhøj H, et al. Long-term cardiac follow-up of children treated with anthracycline doses of 300mg/m2 or less for acute lymphoblastic leukemia. Pediatr Blood Cancer 2010;54:444-8.
11. Lipshultz SE, Lipsitz SR, Sallan SE, et al. Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia. J Clin Oncol 2005;23:2629-36.
12. Amigoni M, Giannattasio C, Fraschini D, et al. Low anthracycline doses-induced cardiotoxicity in acute lymphoblastic leukemia long-term female survivors. Pediatr Blood Cancer 2010;55:1343-7.
13. Möller TR, Garwicz S, Barlow L, et al. Decreasing late mortality among five-year survivors of cancer in childhood and adolescence: a population-based study in the Nordic countries. J Clin Oncol 2001;19:3173-81.
14. Lipshultz SE, Lipsitz SR, Mone SM, et al. Female sex and higher drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N Eng J Med 1995;332:1738-43.
15. Visscher H, Ross CJ, Rassekh SR, et al. Pharmacogenomic prediction of anthracycline-induced cardiotoxicity in children. J Clin Oncol 2011;29:1-12.
16. Adams MJ, Hardenbergh PH, Constine LS, et al. Radiation-associated cardiovascular disease. Crit Rev Oncol Hematol 2003;45(1):55-75.
17. Guldner L, Haddy N, Pein F, et al. Radiation dose and long term risk of cardiac pathology following radiotherapy and anthracycline for a childhood cancer. Radiother Oncol 2006;81:47-56.
18. Kenney LB, Nancarrow CM, Najita J, et al. Health status of the oldest adult survivors of cancer during childhood. Cancer 2010;116:497-505.